Composti aromatici
Benché l'aggettivo aromatico derivi dal fatto che i primi composti di questa classe a essere scoperti e identificati in passato possedessero odori intensi e caratteristici, oggi sono definiti come composti aromatici tutti i "composti organici" che contengono uno o più anelli aromatici nella loro struttura[1]. La presenza di tali anelli conferisce loro reattività particolari, molto diverse da quelle dei composti alifatici aventi peso molecolare e gruppi funzionali simili.
Indice
1 Descrizione
2 Chimica dei composti aromatici
3 Reazioni dei composti aromatici
3.1 Sostituzione elettrofila
4 Anelli aromatici a 6 elettroni
5 Note
6 Bibliografia
7 Voci correlate
8 Altri progetti
9 Collegamenti esterni
Descrizione |
L'aromaticità può essere definita come l'abbassamento di energia dello stato fondamentale della molecola dovuto alla delocalizzazione degli elettroni π sull'intera molecola.[2] Poiché gli orbitali π nascono dall'interazione di orbitali p, i quali sono bilobati sopra e sotto il piano della molecola, la delocalizzazione degli orbitali π porta alla formazione di due orbitali toroidali sopra e sotto la molecola.

Modello della molecola del benzene
Un anello aromatico è un sistema ciclico a struttura planare in cui tutti gli atomi coinvolti condividono tramite i loro orbitali p un totale di 4n+2 elettroni, dove n è un intero positivo (regola di Hückel).
Tale configurazione risulta particolarmente stabile; al punto che, benché la formula bruta dei composti aromatici possa far pensare ad una elevata presenza di doppi e tripli legami, la reattività dei composti aromatici è completamente diversa da quella degli alcheni e degli alchini. Mentre questi ultimi tendono a reagire addizionando atomi a sé, gli anelli aromatici tendono invece a preservarsi, favorendo reazioni di sostituzione.
Capostipite dei composti aromatici è il benzene, avente formula bruta C6H6. La sua struttura è planare e presenta i sei atomi di carbonio disposti ai vertici di un esagono regolare; i legami tra due atomi di carbonio vicini sono intermedi - in termini di lunghezza e di forza - tra un legame singolo ed un legame doppio.
Ogni atomo di carbonio è legato ad altri due e ad un idrogeno tramite i suoi tre orbitali ibridi sp2; il quarto elettrone spaiato è condiviso con gli altri tramite un orbitale p, perpendicolare al piano della molecola; l'anello prodotto dalla fusione dei sei orbitali p contiene quindi 6 elettroni.
La struttura del benzene può essere considerata come un ibrido di risonanza tra più strutture simili (in figura sono riportate le due principali).
La reattività e la stabilità tipiche dei composti aromatici non sono solo limitate agli idrocarburi. Anche i cosiddetti composti eterociclici, cioè composti ciclici il cui anello è formato anche da atomi diversi dal carbonio, possono essere aromatici. È il caso, ad esempio, del pirrolo (C4H5N), il cui anello è un sistema aromatico a sei elettroni: uno da ciascun atomo di carbonio e due dall'azoto.
Chimica dei composti aromatici |
I composti chimici contenenti anelli benzenici sono, come già detto, relativamente più stabili dei corrispondenti alcheni e di conseguenza tendono a reagire in maniera differente, attraverso reazioni che tendono a preservare l'integrità dell'anello aromatico e la stabilità che ne consegue. Prendiamo ad esempio l'addizione di cloro al benzene:

Se la reazione dovesse avvenire secondo il meccanismo numero uno (addizione al doppio legame), la molecola perderebbe la stabilità conferitale dal sistema aromatico. Attraverso il meccanismo due (sostituzione), è conservata la stabilità aromatica. I composti aromatici quindi non subiscono preferenzialmente, come per gli alcheni, reazioni di addizione elettrofila, ma di sostituzione elettrofila.
Si noti che nella reazione non si è tenuto conto della presenza di un catalizzatore (AlCl3, FeBr3) che è indispensabile per fare avvenire la reazione e, a rigore, andrebbe scritto.
Reazioni dei composti aromatici |
Sostituzione elettrofila |
Sono le più caratteristiche reazioni degli areni ed avvengono quando essi reagiscono con agenti elettrofili. Tali reagenti possono essere sia ioni positivi (E+) che specie elettron-deficienti con una parziale carica positiva.
Alcune tipiche reazioni di sostituzione elettrofila aromatica sull'anello benzenico sono:
- Alogenazione
FeX3
C6H6 + X2 -----> C6H5-X + HX
dove X rappresenta un alogeno.
- Nitrazione
H2SO4
C6H6 + HNO3 ------> C6H5-NO2 + H2O
- Solfonazione
SO3
C6H6 + H2SO4 ----> C6H5-SO3H + H2O
- Alchilazione di Friedel-Crafts
AlCl3
C6H6 + R-Cl ------> C6H5-R + HCl
dove R rappresenta un radicale alchilico.
- Acilazione di Friedel-Crafts
AlCl3
C6H6 + R-C=O ------> C6H5-C=O + HCl
| |
Cl R
dove R rappresenta un radicale alchilico.
Anelli aromatici a 6 elettroni |

Benzene

Pirrolo

Furano

Tiofene

Piridina

Piridazina

Pirimidina
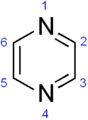
Pirazina

Pirazolo

Imidazolo

Ossazolo
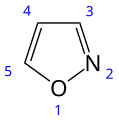
Isossazolo

Tiazolo
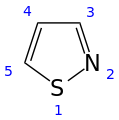
Isotiazolo
Note |
^ (EN) "arenes", in IUPAC Gold Book
^ (EN) "aromatic", in IUPAC Gold Book
Bibliografia |
- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 404-479, ISBN 88-08-09414-6.
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 313-336, ISBN 3-527-30578-5.
Voci correlate |
- Arile
- Composti antiaromatici
- Composti alifatici
- Sistematica organica
- Pygas
- Regola di Hückel
- Riduzione di Birch
- Anello aromatico semplice
- Idrocarburi aromatici
Altri progetti |
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su composto aromatico
Wikimedia Commons contiene immagini o altri file su composto aromatico
Collegamenti esterni |
- Composti aromatici (PPT), su amscampus.cib.unibo.it. URL consultato il 18 luglio 2009 (archiviato dall'url originale il 9 dicembre 2008).
- Esperienze in laboratorio - Gli idrocarburi aromatici, su itchiavari.org.
.mw-parser-output .navbox{border:1px solid #aaa;clear:both;margin:auto;padding:2px;width:100%}.mw-parser-output .navbox th{padding-left:1em;padding-right:1em;text-align:center}.mw-parser-output .navbox>tbody>tr:first-child>th{background:#ccf;font-size:90%;width:100%}.mw-parser-output .navbox_navbar{float:left;margin:0;padding:0 10px 0 0;text-align:left;width:6em}.mw-parser-output .navbox_title{font-size:110%}.mw-parser-output .navbox_abovebelow{background:#ddf;font-size:90%;font-weight:normal}.mw-parser-output .navbox_group{background:#ddf;font-size:90%;padding:0 10px;white-space:nowrap}.mw-parser-output .navbox_list{font-size:90%;width:100%}.mw-parser-output .navbox_odd{background:#fdfdfd}.mw-parser-output .navbox_even{background:#f7f7f7}.mw-parser-output .navbox_center{text-align:center}.mw-parser-output .navbox .navbox_image{padding-left:7px;vertical-align:middle;width:0}.mw-parser-output .navbox+.navbox{margin-top:-1px}.mw-parser-output .navbox .mw-collapsible-toggle{font-weight:normal;text-align:right;width:7em}.mw-parser-output .subnavbox{margin:-3px;width:100%}.mw-parser-output .subnavbox_group{background:#ddf;padding:0 10px}
.mw-parser-output .CdA{border:1px solid #aaa;width:100%;margin:auto;font-size:90%;padding:2px}.mw-parser-output .CdA th{background-color:#ddddff;font-weight:bold;width:20%}
| Controllo di autorità | LCCN (EN) sh85007397 · GND (DE) 4129374-5 |
|---|













